Unternehmen
Interaktive Demos
Diese Demo beschäftigt sich mit der Bestimmung der Koeffizienten einer chemischen Reaktionsgleichung. Diese Gleichungen beschreiben qualitativ und quantitativ die Wechselwirkung zwischen chemischen Verbindungen/Elementen. Auf der linken Seite einer solchen Gleichung werden die Ausgangsverbindungen angeführt, auf der rechten Seite die entstehenden Reaktionsprodukte.
Beispiele
2 Na + Cl2 =
2 NaCl
C2H5OH +
3 O2 =
2 CO2 +
3 H2O
Anzahl und Art der Atome müssen auf beiden Seiten der Gleichung ident sein. Mit Hilfe der sogenannten stöchiometrischen Koeffizienten, im Beispiel blau angeführt, wird sichergestellt, dass sich auf beiden Seiten der Gleichung die gleiche Anzahl von Atomen eines Elementes befinden. Die Ermittlung dieser Koeffizienten wird auch als das Einrichten einer chemischen Gleichung bezeichnet. Solche Gleichungen finden ihr Hauptanwendungsgebiet in der Anorganischen Chemie, während in der Organischen Chemie eher Strukturformeln zur Beschreibung einer Reaktionsgleichung herangezogen werden. Bei einfacheren Gleichungen können die Koeffizienten durch Probieren ermittelt werden, während sich bei komplexeren Gleichungen dieser Ansatz oft als umständlich erweist.
Beispiel für eine komplexere Gleichung3 As2S3 + 28 HNO3 + 4 H2O = 6 H3AsO4 + 9 H2SO4 + 28 NO
Stöchiometrische Gleichung lösen
Bedienung
-
Eingabe: In diesem Feld können Sie eine chemische Gleichung eingeben.
Faktoren werden einfach als Zahlen eingegeben - z.B. H20.
Die Schaltfläche lösen bestimmt die
fehlenden Koeffizienten der Gleichung, löschen - löscht alle Felder.
Die korrekte Darstellung der Eingabe erfolgt simultan im Feld
Gleichung, das
die Faktoren der Elemente tiefergestellt anzeigt. Die aktuelle Version
unterstützt keine Ionenschreibweise.
Eine gültige Gleichung muss folgende Kriterien erfüllen:- Auf beiden Seiten der Gleichung sind die gleichen Elemente vorhanden.
-
Elemente werden durch die internationalen Symbole dargestellt:
H Wasserstoff bis U Uran - Hinweis: Der IUPAC-Nomenklatur entsprechend wird Jod mit I dargestellt! - Gültige Operatoren: + = ( ) [ ] { } - Hinweis: Die Anzahl der öffnenden und schließenden Klammern muss gleich sein!
- Gleichung: Im diesem Feld wird die Gleichung ohne Koeffizienten dargestellt.
- Ergebnis: Im diesem Feld wird die Gleichung mit den ermittelten Koeffizienten oder die entsprechende Fehlermeldung dargestellt.
Mathematischer Hintergrund
Dieses Servlet wendet das Gaußsche Eliminationsverfahren an, um die fehlenden Koeffizienten einer chemischen Gleichung zu ermitteln. Als Erläuterung möge folgendes Beispiel dienen: Durch Einleiten von Chlor in heiße Kalilauge entstehen folgende Reaktionsprodukte: Kaliumchlorat, Kaliumchlorid und Wasser.
x1 KOH + x2 Cl2 = x3 KClO3 + x4 KCl + x5 H2O
Es ergibt sich für die Anzahl der K,O, H und Cl-Atome folgender Zusammenhang:
|
x1 =
x3 +
x4
x1 = 3x3 + x5 x1 = 2x5 2x2 = x3 + x4 |
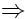
|
x1 -
x3 -
x4 =
0
x1 - 3x3 = x5 x1 = 2x5 2x2 - x3 - x4 = 0 |
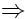
|
1 0 -1 -1 0
1 0 -3 0 1 1 0 0 0 2 0 2 -1 -1 0 |
Als ein Teilschritt des Gaußschen Eliminationsverfahrens wird diese Matrix durch folgende Umformungen in die sogenannte Halbdiagonalform übergeführt:
Die Lösungsmenge des Gleichungssystems ändert sich nicht- bei Vertauschen zweier Zeilen der Matrix.
- bei Multiplikation einer Zeile der Matrix mit einem Faktor ungleich 0.
- bei Multiplikation einer Zeile mit einem Faktor und Addition zu einer anderen Zeile der Matrix.
Mit Hilfe der Operationen i.-iii. ergibt sich folgende Halbdiagonalform der Matrix
1 0 0 0 2
0 2 -1 -1 0
0 0 -3 0 -1
0 0 0 3 5
Als letzter Schritt werden die Koeffizienten der Gleichung durch die sogenannte Rücksubstitution ermittelt, dabei sind nur ganzzahlige Koeffizienten von Interesse. Somit ergibt sich folgende Lösung:
|
x1 = 6
x2 = 3
x3 = 1
x4 = 5
x5 = 3
|
ergibt |
6 KOH +
3 Cl2 =
KClO3 +
5 KCl +
3 H2O
|